新GSP四项关键内容调整 将电子监管系统改为药品追溯体系
发布时间:2016-07-22 来源:佚名
2016年7月20日,CFDA出台新法规文件《国家食品药品监督管理总局关于修改<药品经营质量管理规范>的决定》(国家食品药品监督管理总局令第28号)。
回顾新版《药品经营质量管理规范》的修订历程,自原卫生部2013年6月1日施行的《药品经营质量管理规范》(中华人民共和国卫生部令第90号)开始,至今共修订两次。第一次为2015年7月1日,CFDA发布的《药品经营质量管理规范》(国家食品药品监督管理总局令第13号),第二次即为本次总局第28号令。
那么,经过两次修订,《药品经营质量管理规范》(GSP)内容具体发生了什么变化?根据笔者理解,总结如下几点:
1首营企业资料收集变动
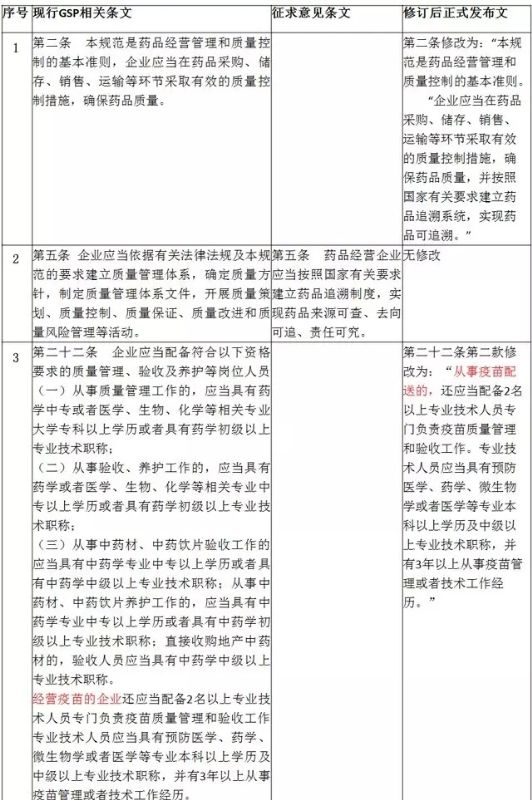
在2015年7月1日的第一次《药品经营质量管理规范》(GSP)修订中,调整主要内容便是首营企业资料收集要求,将“营业执照年检证明”替换为“上一年度企业年度报告公示情况”,适应工商部门调整营业执照年度报告制度。
该资料要求调整后,药品经营企业需修订企业质量管理体系文件,相应调整首营企业资料收集要求,并及时收集该项资料审核归档。另外,根据《国务院办公厅关于加快推进“三证合一”登记制度改革的意见》(国办发[2015]50号),首营企业资料收集中,调整为“营业执照、税务登记、组织机构代码证复印件”。
2“疫苗经营企业相关要求”调整为“疫苗配送企业要求”
2016年3月,由于发生疫苗事件,疫苗质量管理引起国家各执政部门高度重视,国务院于2016年4月份修订了《疫苗流通和预防接种管理条例》(中华人民共和国国务院令第668号),规定疫苗生产企业直接向县级疾病预防控制机构配送第二类疫苗,或者委托具备冷链储存、运输条件的企业配送,减少疫苗多次经营流转,降低由于运输、贮存温湿度监控不当所造成的对疫苗质变的风险。
本次新修订《药品经营质量管理规范》(GSP)中,适应国务院新管理条例的内容,严格监管疫苗质量管理,具备疫苗经营范围且受疫苗生产企业委托配送的经营企业,仍需严格按照新修订《药品经营质量管理规范》(GSP)第二十二条规定配置相应人员。
3电子监管系统调整为药品追溯体系
2016年2月20日,CFDA发布《总局关于暂停执行2015年1号公告药品电子监管有关规定的公告》(2016年第40号),暂停了药品生产经营企业国家电子监管相关工作。暂停期间,多个药品经营企业人员也曾咨询笔者,是否还需继续执行国家电子监管码“见码扫,数据上传”工作?是否真的完全取消电子监管码,那么取消之后如何实现药品追溯性?
本次新修订《药品经营质量管理规范》(GSP),调整幅度最大的内容便是国家电子监管相关规定,调整后法规中提出新字眼“药品追溯”,对药品流通环节中药品经营企业如何执行药品追溯制度提出操作性要求,新修订《药品经营质量管理规范》(GSP)中,明确“企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯”“企业应当建立能够符合经营全过程管理及质量控制要求的计算机系统,实现药品可追溯。”
4强化冷链管理
本次新修订《药品经营质量管理规范》(GSP)中,强化对于冷藏、冷冻药品温湿度控制要求,明确冷藏、冷冻药品在贮存、运输过程当中,必须配置相应的设施设备,确保全过程冷链管理。同样,目的是降低由经营流通环节种由于经营企业温湿度控制工作执行不到位而造成冷链产品质变的风险,确保使用患者生命安全。
现行《药品经营质量管理规范》、2月20日修订草案、新修订后正式发布稿的变化